
آنچه در این مقاله میخوانید
حلالیت یک مفهوم اساسی در شیمی است که توانایی یک ماده را برای حل شدن در یک حلال خاص و در شرایط خاص توصیف می کند.
محلول مخلوطی همگن از یک یا چند املاح در نوعی حلال است. یک مثال رایج از محلول، بلورهای شکر است که به یک فنجان چای یا قهوه اضافه می شود.
حلالیت، توانایی حل شدن یک ماده در یک حلال خاص است و درک آن در بسیاری از زمینه های علمی، از جمله داروسازی، علوم محیطی و علم مواد ضروری است.
در این مقاله به بررسی مفاهیم کلیدی مانند عوامل تاثیر گذار بر حلالیت و نحوه برهمکنش فازهای مختلف ماده با یکدیگر می پردازیم. با ما همراه باشید.
حلالیت به بیشترین مقدار املاح اطلاق می شود که می تواند در یک مقدار مشخص حلال در یک دمای معین حل شود.
در مثال قبل، محلول شکر در یک فنجان چای یا قهوه که مخلوطی همگن است، حلالیت خاصیتی است که به مولکول های شکر اجازه حل شدن می دهد.
در نتیجه، می توان حلالیت را به عنوان توانایی یک ماده برای حل شدن در یک حلال خاص تعریف کرد و هر ماده ای که در یک حلال حل شود، اعم از جامد، مایع یا گاز، به عنوان املاح (حل شونده) شناخته می شود.
حلال شیمیایی، جزء اصلی محلول است که بیشترین مقدار را دارد و شکل فیزیکوشیمیایی املاح یا حل شونده را به صورت جامد، مایع یا گاز تعیین می کند.

مکانیزم کلی حلالیت شیمیایی
از نظر شیمیایی، حلالیت به ایجاد پیوند جدید بین مولکول های حل شونده و حلال اشاره دارد و هر چه تعداد پیوندهای ایجاد شده بیشتر باشد، میزان حل شدگی بیشتر خواهد بود.
املاح یا مواد حل شونده، بر اساس میزان غلظتی که در یک حلال حل می شوند، به عنوان بسیار محلول، کم محلول یا نامحلول طبقه بندی می شوند:
در نتیجه، میزان حلالیت به عنوان یک بیان کمی که بر حسب گرم بر لیتر (g/L) اندازه گیری می شود، تعریف می شود.
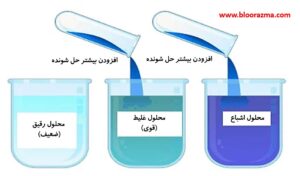
حالت های مختلف حل شوندگی
“فراورده حلالیت“، حداکثر غلظت مولی یون های تولید شده توسط تفکیک مولکول است و در دمای معین ثابت می ماند.
هر چه مقدار فراورده یا محصول کمتر باشد، میزان حلالیت کمتر است و هر چه مقدار محصول بیشتر باشد، انحلال پذیری بیشتر خواهد بود. عناصری که بر حلالیت تأثیر می گذارند، بسته به شرایط و حالت های املاح متفاوت است:
می دانیم که برخی از مایعات در هر نسبتی می توانند با یکدیگر مخلوط شوند. به عبارت دیگر حلالیت متقابل نامتناهی دارند و می گویند امتزاج پذیر (miscible) هستند.
اتانول، اسید سولفوریک و اتیلن گلیکول نمونه هایی از مایعاتی هستند که کاملاً با آب قابل اختلاط هستند. آب به عنوان یک حلال جهانی شناخته می شود زیرا عملاً همه املاح را، به استثنای چند مورد، در خود حل می کند.
مایعاتی که به هر نسبت با آب مخلوط می شوند، معمولاً مواد قطبی یا موادی هستند که پیوندهای هیدروژنی تشکیل می دهند. برای چنین مایعاتی، جاذبه های دوقطبی-دوقطبی (یا پیوند هیدروژنی) مولکول های املاح با مولکول های آب قوی است. از این رو، به راحتی با هم مخلوط می شوند.
به همین ترتیب، مایعات غیرقطبی با یکدیگر قابل اختلاط هستند، زیرا تفاوت قابل ملاحظه ای در قدرت جاذبه های بین مولکولی حلال-حلال و حل شونده-حلال وجود ندارد.
دو مایعی که به میزان قابل توجهی با هم مخلوط نمی شوند، غیر قابل امتزاج (immiscible) نامیده می شوند. وقتی مایعات غیرقابل اختلاط را در یک ظرف مشترک می ریزیم، به صورت لایه ای بر روی هم قرار می گیرند.
بنزین، روغن، برخی از رنگ ها و بسیاری از مایعات غیرقطبی دیگر با آب غیرقابل اختلاط هستند. جاذبه بین مولکول های چنین مایعات غیرقطبی و مولکول های آب قطبی بسیارضعیف است.
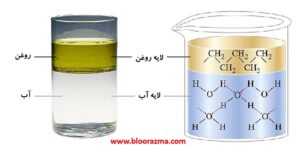
حل شدن روغن در آب
مایعات امتزاج پذیر، حلالیت متقابل بی نهایت دارند، در حالی که مایعاتی که گفته می شود غیرقابل اختلاط هستند حلالیت متقابل بسیار کمی (هر چند نه صفر) دارند.
دو مایع که دارای حلالیت متقابل متوسطی هستند، تا حدی قابل امتزاج (partially miscible) هستند و معمولاً هنگام مخلوط شدن دو لایه تشکیل می دهند.
برای مثال، محلول بروم و آب را در نظر بگیرید. در این مورد، لایه بالایی آب با حالت اشباع از برم، و لایه پایینی برم با حالت اشباع از آب تشکیل می شود.
از آنجایی که برم غیرقطبی است، و بنابراین، در آب خیلی محلول نیست، در لایه بالایی، به دلیل برم حل شده در آب، به نارنجی روشن تغییر رنگ می دهد. در حالی که در لایه پایینی که حلالیت آب در برم بسیار کم است، تأثیر محسوسی بر رنگ تیره برم وجود ندارد.

حل شدن جزئی بروم در آب
حلالیت جامد هم به ترکیب املاح و هم به حلال وابسته است. با توجه به مشاهدات و داده های تجربی مختلف، تنها املاح قطبی ترجیح می دهند در حلال های قطبی حل شوند، در حالی که موارد غیر قطبی تنها در حلال های غیر قطبی حل می شوند.

حل شدن جامدات در آب
انحلال یک جامد در مایعات زمانی اتفاق می افتد که ذرات املاح جامد به طور کامل در حلال حل شوند.
با حل شدن ذرات در مایع، یک حالت تعادل دینامیکی ایجاد می شود که در این مرحله تعداد مولکول های املاح وارد شده به محلول برابر با تعداد ذرات خروجی از محلول است. در نتیجه در دما و فشار معین، غلظت املاح در محلول ثابت می ماند.
محلول اشباع شده محلولی است که در آن هیچ املاحی دیگری نمی تواند در یک دما و فشار معین به حلال اضافه شود و دارای حداکثر مقدار املاح است.
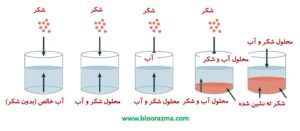
حالت فوق اشباع
میزان حلالیت، قویاً به دما بستگی دارد و از این ویژگی می توان برای تهیه محلول های فوق اشباع او با ترکیبات خاص استفاده کرد.
حلالیت گاز در مایعات به شدت تحت تأثیر دما و فشار و همچنین ماهیت املاح و حلال است. بسیاری از گازها به سرعت در آب حل می شوند، در حالی که برخی دیگر در شرایط معمولی حل نمی شوند.
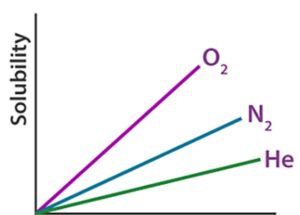
برای مثال، در شرایط مشابه، حلالیت اکسیژن در آب تقریباً سه برابر بیشتر از هلیوم است، اما 100 برابر کمتر از حلالیت کلرومتان CHCl3 است.
هنگامی که دمای یک رودخانه، دریاچه یا نهر به طور غیرعادی بالا می رود، معمولاً به دلیل تخلیه آب گرم از برخی فرآیندهای صنعتی، حلالیت اکسیژن در آب کاهش می یابد. کاهش سطح اکسیژن محلول ممکن است عواقب جدی برای سلامت اکوسیستم آب داشته باشد و در موارد شدید می تواند منجر به مرگ ماهی در مقیاس بزرگ شود.
همچنین، حلالیت یک املاح گازی تحت تأثیر فشار جزئی است که محلول در معرض آن قرار دارد و با افزایش فشار گاز، افزایش می یابد. نوشیدنی های گازدار تصویر خوبی از این رابطه ارائه می دهند.
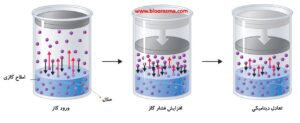
مراحل حل شدگی یک گاز
برای بسیاری از املاح گازی، رابطه بین حلالیت Cg و فشار جزئی Pg، به صورت یک معادله تناسب بیان می شود:
Cg=kPg
k ثابت تناسب است که به هویت املاح گازی و حلال و به دمای محلول بستگی دارد (قانون هِنری) یا به عبارت دیگر، مقدار گاز ایده آلی که در حجم معینی از مایع حل می شود، با فشار گاز نسبت مستقیم دارد.
قانون هنری
میزان حلالیت، شاخصی است که نشان می دهد که یک ماده تا چه میزان در یک حلال حل می شود و محلول تشکیل می شود (که معمولاً به صورت گرم بر لیتر بیان می شود).
میزان حلالیت یک ماده (جامد، مایع و یا گاز) همواره یکسان نیست و ممکن است در یک سیال حلال به صورت کامل انجام شود (کاملاً قابل امتزاج، به عنوان مثال، متانول و آب) و یا جزئی باشد (بروم و آب فقط کمی حل می شوند).
میزان حل شدن یک ماده در ماده دیگر توسط چندین عامل تعیین می شود، از جمله انواع و قدرت نسبی نیروهای جاذبه بین مولکولی که بین اتم ها، یون ها و مولکول های وجود دارد. هرچه نیروی بین املاح و حلال بیشتر باشد، پیوندهای بیشتر برقرار شده و در نتیجه میزان حلالیت بالاتر خواهد بود.
یکی دیگر از عمامل تأثیرگذار بر میزان حل شدن، فشار است که به طور قابل توجهی بر گازها تأثیر بیشتری نسبت به جامدات و مایعات دارد. هنگامی که فشار جزئی گاز افزایش می یابد، احتمال حل شدن آن نیز افزایش می یابد.
عامل بسیار مهم دیگر دمای محلول است. افراد می توانند با تنظیم دما، ویژگی حلالیت یک املاح را افزایش داده یا تغییر دهند. با افزایش دما می توان ترکیبات جامد یا مایع کم حل شونده را در یک حلال حل کرد.
اما در مورد یک ماده گازی، دما در جهت مخالف بر حلالیت تأثیر می گذارد، به این معنی که با افزایش دما، گازها منبسط شده و از حلال خود خارج می شوند.
در این مقاله انواع حل شدگی ها را مورد بررسی قرار دادیم و دیدیم که هرکدام روند مخصوص به خود را دارند. امیدواریم که مفید بوده باشد.
مقالات منتشر شده در ساعاتی قبل