
طیف سنجی فلورسانس و رایج ترین تکنیک های مربوط به آن-از 0 تا 100
طیف سنجی فلورسانس یک روش تحقیقاتی بر اساس ویژگی های فلورسانسی ماده نمونه مورد مطالعه است و برای اندازه گیری کمی محصولات شیمیایی استفاده می شود.
طیف سنجی فلورسانس چگونه تکنیکی است؟
طیف سنجی فلورسانس یک روش تحقیقاتی بر اساس ویژگی های فلورسانسی ماده نمونه مورد مطالعه است و برای اندازه گیری کمی محصولات شیمیایی استفاده می شود.
طیف سنجی فلورسانس یک مولکول را بر اساس خواص فلورسنت آن تجزیه و تحلیل می کند که نوعی خاصیت نورتابی است که در ترکیبات شیمیایی مختلفی اتفاق می افتد.
طیف سنجی فلورسانس بر مبنای جذب امواج الکترومغناطیسی (تابش نور یا حرارت) توسط مولکول ها در حالت پایه انرژی و رسیدن آنها به حالت برانگیخته به وجود می آید.
در حقیقت، از پرتوی نور استفاده می شود که الکترون های موجود در مولکول های ترکیبات خاص را تحریک کند و باعث شود آنها نور ساطع کنند.
یك ماده فلورسانس، انرژی دریافتی را در خود ذخیره می كند و در نهایت آن انرژی را به شکل طیفی از امواج مرئی منتشر می كند که این پدیده سریع است و بلافاصله پس از جذب نور، آغاز و با قطع تابش ورودی، سریعاً خاموش می شود.
در آخر، نور ساطع شده به سمت یک فیلتر و به یک آشکارساز برای اندازه گیری و شناسایی مولکول یا تغییرات در مولکول هدایت می شود.

اصطلاح فلورسانس به پدیده کلی لومینسانس اشاره دارد که انتشار نور از یک مولکول است و انواع مختلفی دارد.
- فوتولومینسانس یا نورتابی (Photoluminescence): زمانی است که انرژی نور یا فوتون ها باعث تحریک الکترون ها می شود.
- فلورسانس: به طور خاص، یک نوع فوتولومینسانس است که در آن نور، یک الکترون را به حالت برانگیخته می رساند. حالت برانگیخته از طریق ارتعاشات به سرعت انرژی حرارتی را به محیط از دست می دهد و سپس یک فوتون از پایین ترین حالت برانگیخته منفرد ساطع می شود.
- شیمی-نور تابی (Chemiluminescence): زمانی است که انرژی شیمیایی باعث تحریک الکترون ها می شود و شامل بیولومینسانس نیز می شود (همانطور که در مگس های درخشان و بسیاری از اشکال حیات دریایی دیده می شود).
- الکترولومینسانس یا نورتابی الکتریکی (Electroluminescence): زمانی است که انرژی الکتریکی یا یک میدان الکتریکی قوی، باعث برانگیختگی می شود، مانند برخی از لامپ های روشنایی.
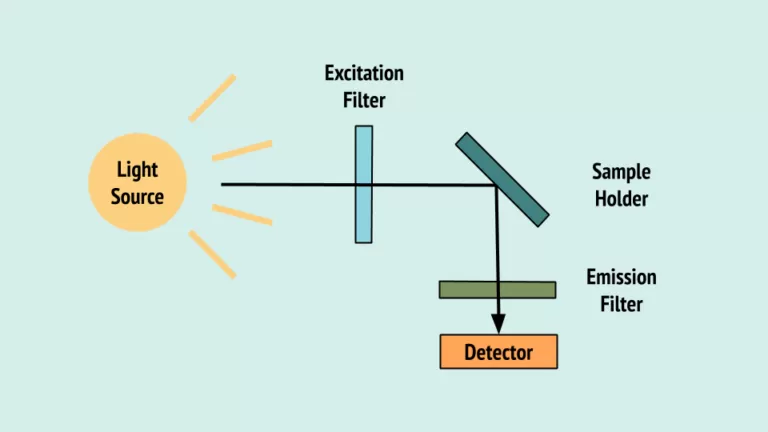
مکانیزم عملکردی طیف سنجی فلورسانس
در دمای اتاق، بیشتر مولکول ها پایین ترین سطح ارتعاشی (حالت الکترونی پایه) را اشغال می کنند و با جذب نور به سطوح انرژی بالا می روند تا حالت های برانگیخته ایجاد کنند.
پس از آنکه الکترون با جذب فوتون پرانرژی (نور با طول موج کوتاه) از تراز پایه به تراز برانگیخته می رود، در وضعیت نامتعادلی قرار می گیرد و تمایل دارد که انرژی خود را از دست بدهد و به تراز پایه برگردد.
در طیف سنجی فلورسانس، ممکن است که الکترون مستقیماً به تراز پایه برنگردد. بلکه ابتدا به ترازهای برانگیخته پایین تر رفته و سپس به تراز پایه اصلی برسد که در این حالت الکترون، فوتون هایی با انرژی کمتر (یعنی طول موج بلندتر) از خود ساطع می کند.
یعنی نور با طول موج معینی را جذب نموده، اما نور با طول موج متفاوتی را گسیل می کند که این پدیده به جا به جایی استوکس موسوم است.
طیف فلورسانس
طیف فلورسانس حالت پایدار زمانی اتفاق می افتد که مولکول هایی که توسط منبع ثابت نور برانگیخته می شوند، نور فلورسنت ساطع می کنند و شدت فوتون های ساطع شده، تابعی از طول موج تشخیص داده می شوند.
طیف انتشار فلورسانس حاصل زمانی است که طول موج تحریک ثابت است و طول موج انتشار اسکن می شود تا نمودار شدت بر حسب برابر طول موج انتشار به دست آید.
به این ترتیب، طیف اطلاعاتی در مورد طول موج هایی که یک نمونه جذب می کند، ارائه می دهد که مشابه با طیف جذب در اسپکتروفتومتر است، اما از نظر محدودیت های تشخیص و ویژگی مولکولی، تکنیک بسیار حساس تری است.
به علاوه، طیف های فلورسانس، مختص یک طول موج/نوع ساطع کننده منفرد هستند، برخلاف طیف جذب اسپکتروفتومتر، که همه گونه های جذب کننده را در یک محلول یا نمونه اندازه گیری می کند.
در طیف سنجی فلورسانس برای بسیاری از مواد، طیف جذب و فلورسانس، تصویر آینه ای یکدیگر هستند که این مورد با عنوان تصویر آینه ای شناخته می شود و مرتبط با اصل فرَنک-کاندون است.

هر دو طیف (جذب و فلورسانس) برای مشاهده چگونگی تغییر یک نمونه استفاده می شود. شدت طیفی و یا قله طیف ممکن است در اثر پارامترهای مختلفی مانند دما، غلظت یا برهمکنش با سایر مولکول های اطراف آن تغییر کند.
چه موادی تابش فلورسانس دارند؟
مولکول ها و مواد فلورسنت در اشکال و اندازه های مختلف وجود دارند که برخی از آنها ذاتاً فلورسنت هستند، مانند کلروفیل و باقی مانده اسید آمینه تریپتوفان (Trp)، فنیل آلانین (Phe) و تیروزین (Tyr).
برخی دیگر مولکول هایی هستند که به طور خاص به عنوان رنگ های آلی پایدار یا برچسب هایی سنتز شده اند تا به سیستم های غیر فلورسنت اضافه شوند.
به طور معمول، مولکول های فلورسنت آلی دارای حلقه های آروماتیک و الکترون های مزدوج Pi هستند و بسته به اندازه و ساختار آنها، می توانند از محدوده فرابنفش تا فروسرخ طیف تابش داشته باشند.
چند دسته از مولکول ها و مواد فلورسنت عبارت اند از:
- اسیدهای آمینه (Trp، Phe، Tyr)
- مشتقات جفت پایه (2-AP، 3-MI، 6-MI، 6-MAP، pyrrolo-C، tC)
- کلروفیل ها
- پروتئین های فلورسنت (FPs)
- رنگ های آلی (فلورسئین، رودامین، N-آمینوکومارین ها و مشتقات آنها)
- عناصر خاکی کمیاب (لانتانیدها)
- نیمه هادی ها
- نقاط کوانتومی
- نانولوله های کربنی تک جداره (SWCNT)
- سلول های خورشیدی
- رنگدانه ها، روشن کننده ها
- فسفرها
- و ...
تبدیل داخلی
به طور کلی در طیف سنجی فلورسانس، یک مولکول برانگیخته پس از دو مرحله متوالی به حالت پایه S0 باز می گردد:
1- مولکول در حالت Sn با اتلاف بخشی از انرژی خود در محیط اطراف، به پایین ترین حالت تک گانه S1 باز می گردد و این پدیده معمولاً تبدیل داخلی نامیده می شود.
2- از حالت برانگیخته S1، مولکول از طریق فرآیندهای رقابتی مختلفی به حالت پایه S0 می رسد که شامل موارد زیر می شود:
- گسیل یک فوتون (فلورسانس)
- بخشی از انرژی جذب شده، به صورت گرما در محیط پخش می شود که این نوع انرژی غیر تابشی است و با یک نرخ ثابت رخ می دهد.
- مولکول های برانگیخته می توانند مقداری از انرژی خود را به مولکول های واقع در نزدیکی خود بدهند که این گذار انرژی با یک نرخ ثابت در برخوردهای خاموش کننده و یا در فاصله اتفاق میافتد.
- گذار به حالت سه گانه برانگیخته T2 با انرژی کمتر از S1، با نرخ ثابت kISC در برخوردهای بین سیستمی رخ می دهد. برای هر حالت برانگیخته S، یک حالت برانگیخته T2 با انرژی کمتر وجود دارد.
- دقت داشته باشید که حالت سه گانه، یک حالت برانگیخته است و بنابراین از نظر انرژی ناپایدار است.
نمودار جابلونسکی
معمولاً موارد توضیح داده شده در بخش قبل، با استفاده از نمودار جابلونسکی نمایش داده می شود، که نمودار گذارهای الکترونی نیز نامیده می شود (شکل زیر).
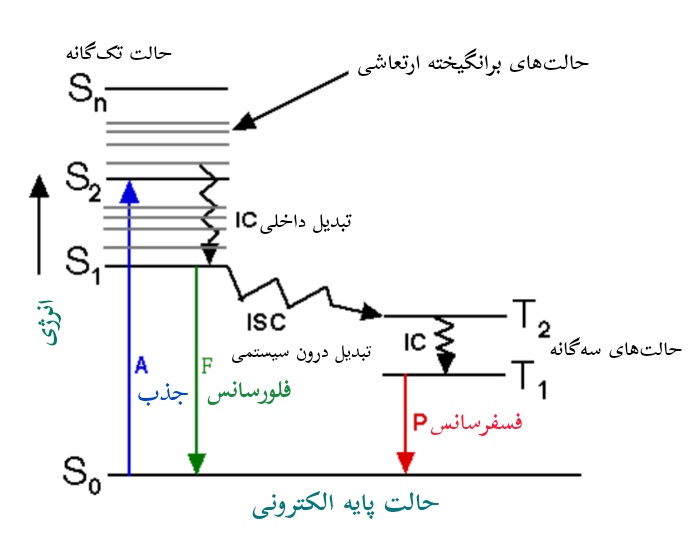
طیف گسترده ای از مواد به عنوان خاموش کننده فرایند فلورسانس عمل می کنند. برای مثال خاموش شدن خاصیت فلورسنت توسط اکسیژن، به دلیل ماهیت پارامغناطیس آن است که باعث می شود انرژی تحت عبور بین سیستمی، به حالت سه گانه برسد.
علاوه بر این، تقریباً تمام مولکول هایی که حالت الکترونی بالاتر از حالت دوم را اشغال می کنند، تحت تبدیل داخلی قرار می گیرند و از پایینترین سطح ارتعاشی حالت فوقانی به بالاترین سطح ارتعاشی از بین حالات برانگیخته پایین تر که انرژی یکسانی دارد، عبور می کنند.
از آنجا، مولکول ها دوباره انرژی خود را از دست می دهند تا زمانی که به پایین ترین سطح ارتعاشی اولین حالت برانگیختگی برسند که از این سطح، مولکول می تواند به هر یک از سطوح ارتعاشی حالت پایه بازگردد و انرژی خود را به شکل فلورسانس ساطع کند.
اگر این فرآیند برای همه مولکول هایی که نور را جذب کرده اند انجام شود، بازده کوانتومی ماده حداکثر خواهد بود و اگر مسیر دیگری دنبال شود، بازده کوانتومی کمتر از یک و حتی ممکن است تقریباً صفر باشد.
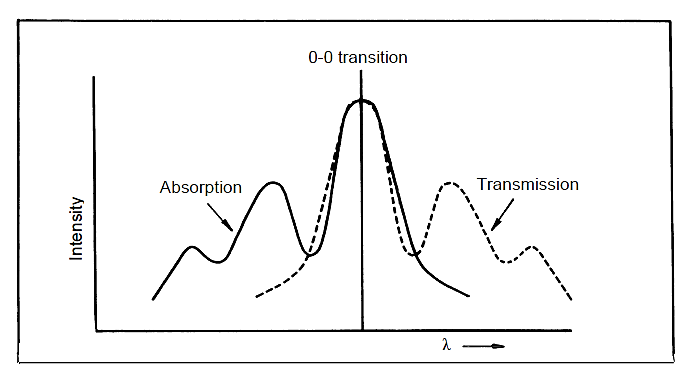
گذار 0→0، که از پایین ترین سطح ارتعاشی حالت الکترونی پایه به پایینترین سطح ارتعاشی در اولین حالت برانگیخته، در هر دو پدیده جذب و انتشار مشترک است، در حالی که گذارهای جذب دیگر به انرژی بیشتری نیاز دارند.
بنابراین می توان انتظار داشت که طیف گسیلی در طول موج مربوط به گذار 0→0 با طیف جذبی همپوشانی داشته باشد و بقیه طیف گسیلی انرژی کمتر یا طول موج بلندتری داشته باشد (شکل زیر).
در عمل، به ندرت گذار 0→0 در طیف جذب و انتشار دقیقاً بر هم منطبق هستند و این عدم انطباق، نشان دهنده اتلاف اندک انرژی از طریق برهمکنش مولکول جاذب نور با مولکول های حلال اطراف است.
سخن پایانی
در این مقاله، به طور مفصل در مورد تکنیک طیف سنجی فلورسانس صحبت شد. مکانیزم عملکردی، اصول بنیادین آن بر پایه فیزیک کوانتوم و انواع آن شرح داده شد. امیدواریم که مفید باشد.
در آخر به شما کاربر عزیز پیشنهاد می کنیم که بخش محصولات شرکت دانش بنیان بلورآزما را نیز مشاهده کنید و در صورت نیاز کاتالوگ هر محصول را به صورت جداگانه دانلود کرده و حتی برای دوستان خود بفرستید.
منابع و مراجع
- Jihad, Principles and applications of fluorescence spectroscopy, Blackwell, 2007. ISBN 978-1-4051-3891-8
Priciple s of Fluorescence Spectroscopy
Molecular Fluorescence: Principles and Applications
An Introduction to Fluorescence Spectroscopy, 2000, PerkinElmer, Inc.
R. Koirtyohann, A history of atomic absorption spectroscopy, Spectrochemical Acta Part B: Atomic Spectroscopy, Volume 35, Issues 11–12, 1980, Pages 663-670, ISSN 0584-8547.



