
انواع گذار ارتعاش مولکولی (5 مورد کلی)
فهرست مطالب
ارتعاش مولکولی از نوسانات مکرر اتم ها در مولکول ناشی می شود. فرکانس یک ارتعاش مولکولی بر اساس جرم اتم ها، قدرت و طول پیوند درون مولکولی تعیین می شود.
گذارهای ارتعاش مولکولی چگونه هستند؟
مقدمه
نوع ارتعاش مولکولی، سطوح انرژی و گذارهای مابین آنها مفاهیمی هستند که از مکانیک کوانتومی گرفته شده اند.
ارتعاش مولکولی از نوسانات مکرر اتم ها در یک مولکول ناشی می شود. هنگامی که مولکول ها انرژی مانند گرما یا نور را جذب می کنند، اتم های آنها شروع به ارتعاش می کنند.
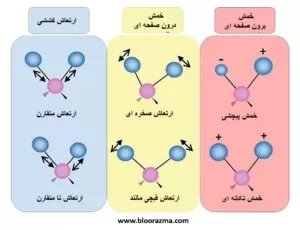
انواع ارتعاش مولکولی می توانند در حالت ها و جهات مختلف از جمله خم شدن، کشش و یا پیچش رخ دهند. فرکانس و انرژی یک ارتعاش مولکولی بر اساس جرم اتم های درگیر و قدرت و طول پیوند درون مولکولی تعیین می شود.
ارتعاش مولکولی نقش مهمی در زمینه های مختلف علمی از جمله شیمی، فیزیک و زیست شناسی دارد. این نوسانات، از طریق تکنیک هایی مانند طیف سنجی مادون قرمز و رامان مورد مطالعه قرار می گیرند که اطلاعاتی در مورد ساختار مولکولی، انواع پیوندهای موجود و گروه های عاملی درون یک مولکول ارائه می دهند.
برای دریافت اطلاعات جزئی تر با ما همراه باشید.
ارتعاش موکلولی چیست؟
درک ارتعاش مولکولی برای پیش بینی و تفسیر خواص و رفتار مولکول ها ضروری است. به عنوان مثال، جذب فرکانس های خاص نور مادون قرمز توسط مولکول ها می تواند برای شناسایی و مشخص کردن ترکیبات شیمیایی استفاده شود.
علاوه بر این، حالت های ارتعاش مولکولی می توانند بر واکنشپذیری شیمیایی و خواص فیزیکی مواد مانند ویسکوزیته و هدایت حرارتی مواد تأثیر بگذارند.
یک مولکول منفرد میتواند به روش های مختلفی ارتعاش داشته باشد که به هر یک از ارتعاشات یا نوسانات مختلف، «حالت» ارتعاشی گفته میشود.
مولکول هایی که فقط دو اتم دارند فقط با نزدیک شدن به هم و سپس دور شدن از هم نوسان می کنند (مانند O2 و N2). در حالی که مولکول هایی با 3 اتم یا بیشتر می توانند در الگوهای پیچیده تری ارتعاش کنند.
این حالت های ارتعاشی می توانند رامان یا فروسرخ فعال باشند. برای اینکه یک حالت در طیف IR مشاهده شود، باید تغییراتی در دوقطبی دائمی آن رخ دهد.
مولکول های دو اتمی در طیف رامان مشاهده می شوند اما در طیف IR مشاهده نمی شوند. این به دلیل این واقعیت است که مولکول های دو اتمی تنها دارای یک پیوند بوده و بنابراین، بدون دو قطبی دائمی هستند. از این رو تنها یک ارتعاش مولکولی واحد دارند.
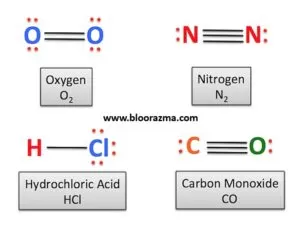
مولکول هایی با تعداد حالت های ارتعاشی بیشتر و بنابراین پیچیده تر، تعامل بیشتری با طیف امواج الکترومغناطیسی دارند. به همین دلیل است که دی اکسید کربن تابش مادون قرمز (IR) را جذب و ساطع می کند، در حالی که مولکول های نیتروژن و اکسیژن این کار را نمی کنند.
مفهوم درجه آزدی
درجه آزادی تعداد متغیرهای مورد نیاز برای توصیف کامل حرکت یک ذره است. برای یک اتم که در فضای سه بعدی حرکت می کند، سه مختصات کافی است، بنابراین درجه آزادی آن سه است زیرا حرکت آن صرفاً انتقالی است.
اگر مولکولی متشکل از N اتم داشته باشیم، درجه آزادی 3N می شود، زیرا هر اتم 3 درجه آزادی دارد. از آنجایی که این اتم ها با یکدیگر پیوند دارند، بنابراین تمام حرکات از نوع انتقالی نخواهند بود.
برای مولکول های غیر خطی، تمام حرکات دورانی را می توان بر حسب چرخش حول 3 محور توصیف کرد و بنابراین، درجه آزادی حرکت چرخشی 3 است و 3N-6 درجه آزادی باقیمانده حرکات ارتعاش مولکولی را تشکیل می دهند (3 درجه انتقالی و 3 درجه چرخشی کم می شود).
اما برای یک مولکول خطی، از آنجایی که دوران حول محور چرخش نیست (زیرا مولکول را بدون تغییر می مانند)، بنابراین تنها 2 درجه آزادی چرخشی برای هر مولکول خطی وجود دارد که 3N-5 درجه آزادی برای ارتعاش باقی می گذارد.
مدل اولیه از ارتعاش مولکولی (هارمونیک)
ارتعاش مولکولی مستقیماً میزان قدرت پیوند را منعکس می کند و با آنالیز آن می توان به اطلاعات مفیدی دست پیدا کرد.
برای ساده نگه داشتن مسائل، کوچک ترین مولکول ممکن را در نظر می گیریم که از دو اتم تشکیل شده است (موسوم به مولکول دو اتمی). این مولکول ها را می توان با استفاده از مفهوم یک نوسان ساز هارمونیک ساده مدل سازی کرد.
در این مدل، دو اتم به عنوان جرم های نقطه ای به هم متصل در نظر گرفته می شوند که توسط یک "فنر" که نیروی الکترواستاتیک بین اتم های باردار را نشان می دهد، به هم متصل می شوند.
نیروی الکتروستاتیک بین دو اتم، متناسب با فاصله یا طول پیوند بین دو مرکز اتمی است (قانون هوک). هنگامی که سیستمی مانند این به حرکت در میآید، دو اتم حول یک نقطه تعادل به عقب و جلو نوسان میکنند (همانند یک فنر).
این با قانون هوک توضیح داده شده است، که بیان می کند که نیروی (F) برابر است با:
F = -kr
k ثابت فنر (ثابت پیوند) و r جابجایی اتم ها است. در ارتعاشات هارمونیک، مولکول در اطراف موقعیت تعادل خود در نوسان است و انرژی ارتعاش به سطوح انرژی ارتعاشی گسسته کوانتیزه می شود.
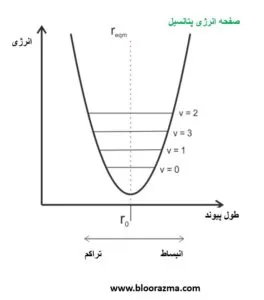
با کاهش فاصله بین دو اتم (r) از طول تعادل، req، نیروی دافعه بین هسته ای بار مثبت غالب است و انرژی ذخیره شده در مولکول افزایش می یابد و با نزدیک شدن فاصله r به صفر، مقدار نیرو به بی نهایت نزدیک می شود.
وقتی r، بیش از req افزایش می یابد، نیروی جاذبه ای ایجاد می شود تا دو اتم را به عقب برگرداند و بنابراین، انرژی بیشتری را ذخیره می کند.
بین این دو نقطه بی نهایت (کرانه ها)، نیروهای دافعه و جاذبه تعادل برقرار می کنند که منجر به حداقل انرژی ذخیره شده مولکول می شود و منحنی حاصل به عنوان یک چاه انرژی توصیف می شود.
در دماهای بالاتر از صفر مطلق، مولکول ها در نزدیکی ته چاه انرژی (چاه پتانسیل) به جلو و عقب نوسان می کنند. جذب انرژی از فوتون ها باعث افزایش نوسان به سطوح انرژی بالاتر در چاه می شود (گذارهای ارتعاشی).
طبق توصیف مکانیک کوانتومی نوسانات هارمونیک، مولکول ها تنها می توانند مقادیر مجازی از انرژی داشته باشند. این بدان معنی است که مولکول ها نمی توانند هر فوتونی با هر انرژی را جذب کنند.
تنها آنهایی که انرژی آنها برابر با اختلاف انرژی بین سطوح کوانتیزه مطابقت دارد (گذارهای ارتعاشی مجاز)، امکان جذب خواهند داشت.
En=hw(n+1/2)
موقعیت اتم ها با یک تابع احتمال توصیف می شود که برای هر سطح انرژی کوانتیزه شده متفاوت است. در پایین ترین حالت انرژی ارتعاشی که حالت پایه نیز نامیده میشود، فاصله r بر روی req منطبق است (یا تقریباً می توان گفت که بر یکدیگر منطبق هستند).
سطوح انرژی بالاتر به عنوان حالت های برانگیخته شناخته می شوند. برای سطوح انرژی ارتعاشی، اختلاف انرژی بین سطوح (انرژی لازم برای گذارهای ارتعاشی) با انرژی فوتون در ناحیه فروسرخ نور مطابقت دارد.
بنابراین طیف سنجی فروسرخ به ما اجازه میدهد تا تغییر انرژی مورد نیاز برای برانگیختن مولکول از حالت پایه به اولین حالت برانگیخته و حالتهای بالاتر فراتر از آن را مشاهده کنیم.
گذار ارتعاشی از حالت پایه به اولین حالت برانگیخته (ν0→ν1) گذار اساسی یا پایه گفته می شود، در حالی که گذار به حالت های انرژی بالاتر (به عنوان مثال ν0→ν2) با عنوان Overtone شناخته می شود.
اختلاف انرژی دقیق بین سطوح ( Δν ) بسته به جرم اتم ها و قدرت پیوند متفاوت خواهد بود. در نتیجه، مولکول های مختلف طیفهای IR متفاوتی دارند.
مدل غیرهارمونیک
در مدل نوسان ساز هارمونیک ساده، فواصل بین این سطوح انرژی برای یک سیستم، نسبت های ثابتی است. در این مدل، گذارهای ارتعاش مولکولی از حالت پایه به دومین حالت برانگیخته، دقیقاً دو برابر رفتن از حالت پایه به اولین حالت برانگیخته اول نیاز دارد.
مدل پیچیده تر که نمایش بهتری از واقعیت ارائه می دهد، مدل نوسان ساز غیر هارمونیک نشان داده شده در شکل زیر است که اختلاف انرژی بین سطوح انرژی بین حالت های برانگیخته بالاتر، شروع به باریک شدن می کند (طبق منحنی مورس).
ارتعاش مولکولی غیر هارمونیک از قانون هوک منحرف می شود و انرژی پتانسیل دیگر با یک تابع درجه دوم تقریب زده نمی شود.
در ارتعاشات غیر هارمونیک، منحنی انرژی پتانسیل می تواند پیچیده تر و غیرخطی باشد. این می تواند به دلیل عواملی مانند پتانسیل های مولکولی ناهارمونیک، تغییرات ارتعاشات ناشی از گذارهای الکترونی یا جفت های غیر خطی بین حالت های مختلف ارتعاشی باشد.
در این حالت غیر هارمونیک، اگر انرژی مورد نیاز برای گذارهای ارتعاشی بین حالت پایه و اولین حالت برانگیخته r باشد، انرژی گذار حالت پایه به دومین حالت برانگیختگی، از 2r کمی کمتر خواهد بود.
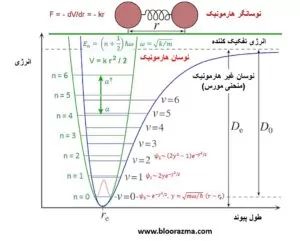
تفاوت اساسی این است که پس از اینکه اتم ها در فاصله معینی از هم فاصله گرفتند و انرژی مولکول به حداکثر برسد، در این مرحله مولکول به دو اتم جداگانه تجزیه می شود.
اگرچه در طول یک گذار الکترونی، مکانیک کوانتومی هیچ محدودیتی برای تغییر عدد کوانتومی ارتعاشیی اعمال نمی کند، با این وجود خطوط ارتعاشی متوالی، همه با شدت یکسانی مشاهده نمی شوند.
اصل فرانک-کاندون و گذارهای ارتعاشی
انواع طیف های ارتعاشی بر اساس اصل فرانک-کاندون توضیح داده می شوند که شدت گذارهای ارتعاشی و جذب یا گسیل یک فوتون را توصیف می کند.
اصل فرانک-کاندون چیست؟
اصل فرانک-کاندون مفهومی است که در مکانیک کوانتومی برای توصیف گذار بین حالات الکترونی یک مولکول در طی یک واکنش شیمیایی یا در هنگام جذبو گسیل نور استفاده می شود.
این اصل بیان می کند که حرکت هسته ای (انرژی ارتعاشی) در طول یک گذار مولکولی، بسیار کندتر از گذار الکترونی اتفاق می افتد.
به عبارت دیگر، موقعیت هسته های اتم در حالت های الکترونی اولیه و نهایی اساساً بدون تغییر باقی می ماند.
انواع مکانیزم های گذار ارتعاش مولکولی
همانطور که در بخش قبل نیز گفته شد، تغییر انرژی یک مولکول دو اتمی نسبت به فاصله بین هسته ای، با منحنی مورس نشان داده میشود که انرژی را زمانی که یکی از اتم ها روی محور r=0 ثابت در نظر گرفته میشود، نشان می دهد و دیگری اجازه دارد بین حدود منحنی نوسان کند.
طبق نظریه کلاسیک، اتم نوسان کننده در یک ارتعاش مولکولی، بیشترین زمان خود را در نقطه عطف حرکت خود بر روی منحنی می گذراند، زیرا در آنجا با کندی حرکت می کند.
اما نظریه کوانتوم، نشان می دهد که برای حالت ν=0، احتمال اینکه اتم در مرکز حرکت خود، یعنی در فاصله تعادل بین هسته ای ( req ) حضور داشته باشد، بیشتر است.
شدیدترین گذار ارتعاشی، گذاری است که در آن حالت ارتعاشی برانگیخته به صورت عمودی بالای حالت ارتعاشی پایه قرار دارد. با این حال، گذار به سایر سطوح ارتعاشی نیز رخ می دهد، اما در این موارد شدت گذارها بسیار کمتر است.
برای درک این حقیقت و با استفاده از اصل فرانک-کاندون، پنج نوع مکانیزم گذار ارتعاش مولکولی را توصیف خواهیم کرد.
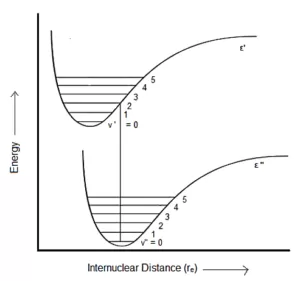
گذار ارتعاشی 1
مورد اول این است که حالت الکترونی بالاتر (' ε) نسبت به حالت الکترونی پایین تر ("ε)، فاصله تعادل بین هسته ای کمتری دارد.
بنابراین گذاری که به صورت عمودی رخ می دهد، از (v” = 0) به (v’=2) است. بنابراین، شدیدترین خط (2,0) خواهد بود، زیرا در این گذار فاصله بین هسته ای تغییر نمی کند.
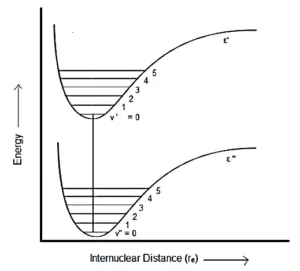
گذار ارتعاشی 2
در حالت دوم، حالت الکترونی بالاتر (' ε) همان فاصله تعادل بین هسته ای (req) را با حالت الکترونی پایینی ("ε) دارد.
بنابراین گذار محتمل، گذاری است که به صورت عمودی اتفاق می افتد، از حالت (v” = 0) به (v’=0) است. بنابراین، شدیدترین خط (0,0) خواهد بود، زیرا در این انتقال فاصله بین هسته ای تغییر نکرده است.
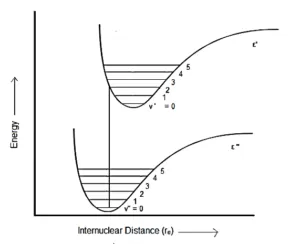
گذار ارتعاشی 3
در سومین نوع گذار، حالت الکترونی بالاتر (' ε) نسبت به حالت الکترونی پایین تر ("ε)، فاصله تعادل بین هسته ای بیشتری دارد.
در اینجا گذاری که به صورت عمودی رخ می دهد، از (v” = 0) به (v’=2) است. بنابراین، شدیدترین خط (2,0) خواهد بود، زیرا در این گذار، فاصله بین هسته ای تغییر نمی کند.
گذار ارتعاشی 4
در مورد حالت چهارم، حالت الکترونی بالاتر (' ε)، نسبت به حالت الکترونی پایین تر ("ε)، فاصله تعادل بین هسته ای بسیار زیادی دارد.
در اینجا، سطح ارتعاشی که گذار به آن انجام میشود، مقدار v بسیار بالایی دارد (برای به دست آوردن یک گذار عمودی).
گذار ارتعاشی 5
علاوه بر موارد بالا، ممکن است گذار به حالتی رخ دهد که در آن مولکول برانگیخته، بیش از انرژی تفکیک خود انرژی دریافت کند. در نتیجه مولکول بدون هیچ گونه ارتعاشی، به اتم های تشکیل دهنده خود تجزیه می شود (یونیزه می شود).
از آنجایی که اتم های تشکیل شده ممکن است هر مقدار انرژی جنبشی را به خود اختصاص دهند، بنابراین، گذار کوانتیزه نمی شود و یک طیف پیوسته خواهیم داشت.
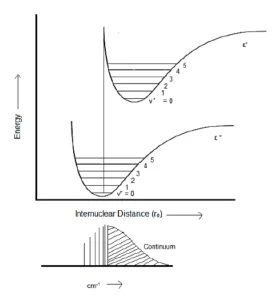
از آنجایی که تفاوت انرژی بین سطوح ارتعاشی در یک سطح الکترونی، در مقایسه با حداقل اختلاف انرژی بین سطوح الکترونی کوچک است، انتقال الکترونی شامل خوشه ای از قله های طیفی با فاصله بسیار نزدیک است.
هر قله دارای عرض قابل توجهی است که با فاصله بین قله ها قابل مقایسه است. این باعث می شود که قله ها آنقدر با هم همپوشانی داشته باشند که یک پیک گسترده به نام باند جذب الکترونی ایجاد شود.
سخن پایانی
انواع مختلف ارتعاش مولکولی اطلاعات ارزشمندی در مورد ساختار و خواص مولکول ها ارائه می دهند و دانشمندان را قادر می سازد تا رفتار آنها را برای کاربردهای عملی مختلف درک و دستکاری کنند.
در این مقاله سعی بر این شد که انواع ارتعاش مولکولی را مورد بررسی قرار دهیم. امیدواریم که این مقاله برای شما مفید بوده باشد.



