
فرایند های جذب و عبور
فهرست مطالب
- <span style="color: #0000ff;">مکانیسم عملکردی طیف سنجی با استفاده از فرایند های جذب و عبور</span>
- <span style="color: #0000ff;">مکانیسم عملکردی فرایند جذب و عبور</span>
- <span style="color: #0000ff;">قانون لامبرت</span>
- <span style="color: #0000ff;">قانون بیر</span>
- <span style="color: #0000ff;">منابع و مراجع</span>
جذب و عبور امواج الکترومغناطیسی، فرایند هایی هستند که در هنگام برهمکنش با ماده ممکن است رخ دهد. جذب و عبور یکی از اصول بنیادین طیف سنجی هستند.
جذب و عبور امواج الکترومغناطیسی در مواد
طیف سنجی، روشی است که در آن برهمکنش نور (امواج الکترومغناطیسی) با ماده مورد بررسی قرار میگیرد و جذب و عبور از جمله برهمکنش هایی هستند که با در دست داشتن طیف حاصل از آنها، اطلاعاتی از قبیل غلظت و ساختار مواد مشخص میگردد.
در حقیقت، حاصل فرآیند جذب در طول موج های مجزا، الگویی از مقادیر جذب نسبت به طول موج (طیف جذب) است که در شناخت ساختاری مواد ناشناخته مورد استفاده قرار می گیرند و مقدار جذب نور تک رنگ، متناسب با غلظت ماده جاذب است، بنابر این روشی برای تخمین کمی ماده نیز به حساب می آید.
اصل اساسی و مشترک بین همه تکنیک های طیف سنجی تاباندن یک پرتو (باریکه ای از نور، دسته ای الکترون و غیره) به یک نمونه و مشاهده نحوه واکنش ماده یا نمونه به چنین محرکی است.
مکانیسم عملکردی طیف سنجی با استفاده از فرایند های جذب و عبور
هنگامی که امواج الکترومغناطیسی با فرکانسی معین به یک اتم یا مولکول برخورد میکنند، بسته به طول موج تابش و ساختار، جذب آنها میشود و به عبارتی دیگر، الکترون موجود تحریک شده و با جذب انرژی به مدار اتمی یا مولکولی بالاتری گذار میکند (به اصطلاح برانگیخته می شود).
از آن جایی که اتم ها و مولکول های مختلف دارای فرکانس های طبیعی مختلفی هستند، فرکانس های مختلف نور را به طور انتخابی جذب میکنند و قادر به جذب هر فرکانسی نیستند و لذا، برخی از طول موج ها (فرکانس ها) از ماده عبور می کنند.
در طیف سنجی نوع جذبی، پرتو ها پس از عبور از نمونه، وارد اسپکترومتر شده و طیف جذب و عبور آن به دست میآید و از طیف جذبی-عبوری برای تعیین غلظت، آنالیز مولکولی، کنترل فرآیند، مطالعات ساختاری و بنیادی استفاده میشود.
مکانیسم عملکردی فرایند جذب و عبور
اوربیتال های الکترونی اتم ها و مولکول ها دارای انرژی های مشخصی هستند که باعث ایجاد مجموعه ای از سطوح انرژی گسسته میشوند و یک الکترون قادر است از یک اوربیتال اشغال شده به اوربیتال دیگر تغییر انرژی داشته باشد و فقط در مقادیری که دقیقاً مطابق با تفاوت بین دو سطح انرژی است، انرژی بدست آورد (جذب) یا از دست بدهد (نشر).
گذار از حالت پایه (حالتی با کمترین انرژی ممکن) در انرژی E0 به سطح بالاتر در انرژی En در صورتی امکان پذیر است که مولکول تابش الکترومغناطیسی طول موج متناظر را جذب کند
که در آن c سرعت نور و h ثابت پلانک است.
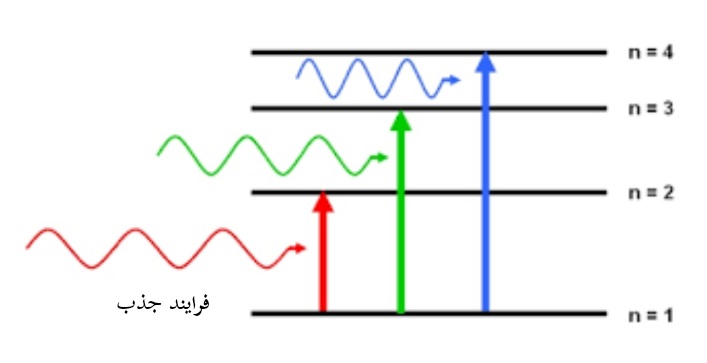
حالت های برانگیخته معمولاً فقط برای مدت زمان بسیار کوتاهی (فمتوثانیه تا میکروثانیه) وجود دارند، زیرا حالت های انرژی بالاتر ناپایدار هستند و انرژی اضافی برای رسیدن به آسایش از طریق فرایند های مختلفی مانند انتشار نور از دست میرود.
مقدار اختلاف انرژی معمولی بین حالت پایه و اولین سطح برانگیخته برای بسیاری از مولکول ها، مربوط به امواج الکترومغناطیسی فرابنفش (UV) و مناطق مرئی طیف الکترومغناطیسی است.
فرآیند جذب در شکل 2 نشان داده شده است و نور در طول موج تشدید با شدت اولیه، Io، بر روی سلول حاوی اتم های در حالت پایه متمرکز می شود. سپس پس از عبور از کووت، نور به سمت آشکارساز هدایت شده و شدت کاهشیافته، I، اندازهگیری میشود و مقدار نور جذب شده با مقایسه I با Io تعیین می شود.
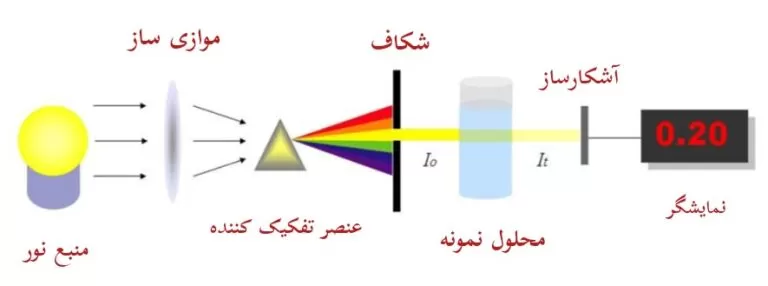
در یک طیف سنج جذبی-عبوری، در هنگام عبور نور از نمونه داخل کووت (محل قرار گیری نمونه)، میزان فوتونی که از داخل نمونه عبور کرده و به آشکارساز میرسد، به طول کووت و غلظت نمونه بستگی دارد.
وقتی که نور از داخل کووت رد میشود، مقداری از آن توسط ماده نمونه جذب شده و مقداری عبور میکند و میزان جذب اندازه گیری شده، به غلظت یک عنصر در محلول مربوط می شود و رابطه بین جذب نور و غلظت نمونه را قانون بیِر-لامبرت می گویند.
قانون لامبرت
قانون لامبرت بیان می کند که بخشی از نور جذب شده توسط یک محیط شفاف، مستقل از شدت نور فرودی است و تمام بخش های محیط، کسری مساوی از نوری که از آن عبور می کند را جذب می کند.
قانون بیر
قانون بیر بیان می کند که جذب نور متناسب با تعداد گونه های جذب کننده در نمونه است و این بدان معنی است که مقدار انرژی (نور) جذب شده متناسب با غلظت ماده نمونه است.
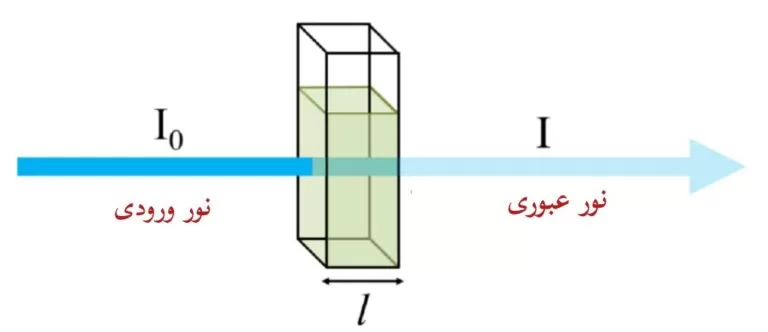
به طور کلی، ترکیب قانون بیر-لامبرت یک ابزار ریاضی برای بیان نحوه جذب و عبور نور توسط ماده (محلول مایع، جامد یا گاز) است و این قانون بیان میکند که مقدار نوری که از یک نمونه عبور می کندیا جذب می شود، توسط سه پدیده فیزیکی تحت تأثیر قرار می گیرد:
1- مقدار ماده جذبکننده (غلظت c)
2- طول مسیر نوری l، یعنی فاصلهای که نور باید در نمونه، طی کند
3- احتمال برهمکنش مولکول با فوتون با انرژی خاص و جذب آن توسط نمونه (ضریب خاموشی یا ضریب جذب ماده، Ԑ)
نمونه ای از ماده ی جاذب را در نظر بگیرید که درون کووت قرار دارد و فرض بر این است که نور با شدت I0 از سمت چپ تابیده می شود و در جهت x منتشر می شود و سپس به دلیل عبور از نمونه، شدت I به آرامی از سمت چپ به راست کاهش می یابد و شدت آن (اگر نمونه همگن باشد)، بدون توجه به مقدار x، در یک بازه کوچک dx یکسان است.
میزان نور انتقال یافته از داخل نمونه را میتوان از رابطه زیر به دست آورد:
Transmittance=ItI۰
It، شدت نور عبوری از کووت و I0 شدت نور منبع است و میزان جذب نور نیز طبق رابطه زیر، با میزان عبور نور از نمونه مرتبط است:
Absorbance = – log (T) = – log ( ItI۰)
از آنجایی که کاهش کسری شدت نور در یک محلول، به طور خطی به غلظت مولکول جذب کننده بستگی دارد، تغییر کسری در شدت نور dI/I را می توان به صورت زیر نوشت:
-dIdt=α.c.dx
α ثابت تناسب است و از آنجا که نه α و نه c، به x بستگی ندارند، با انتگرال گیری بین حد I0 در x=0 و It در x=l، خواهیم داشت:
ln(I۰IT)=α.c.l
یا به عبارت دیگر، خواهیم داشت:
It=I۰ e-α.c.l
برای اندازه گیری هایی که با کووت هایی با طول مسیر های مختلف انجام میشود، شدت عبور، It، با افزایش طول مسیر بهطور تصاعدی کاهش مییابد.
متناوباً، با افزایش غلظت، شدت میزان عبور نور به صورت تصاعدی کاهش می یابد. میزان جذب یا چگالی نوری، A، بر حسب لگاریتم بر پایه 10 به جای لگاریتم طبیعی تعریف می شود:
A = log (I۰ / It) = ɛ.l.c
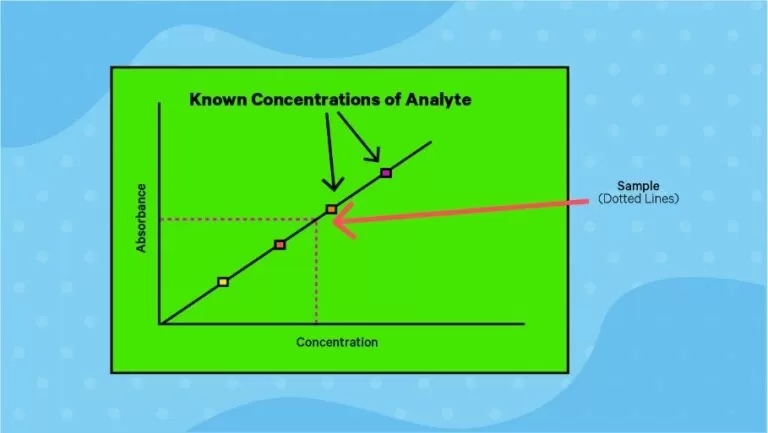
که ɛ نشان دهنده ضریب جذب مولی، l طول مسیر عبور نور و c غلظت نمونه است و برای تعیین غلظت نمونه مجهول، از همان نمونه در غلظت های مختلف تهیه میشود و میزان جذب آن ها (هم نمونه مجهول و هم سایر نمونه ها) در یک طول موج مشخص اندازهگیری میگردد و با رسم نمودار خطی غلظت و جذب (شکل 4)، غلظت نمونه مجهول به دست میآید و وابستگی A یا Ԑ به طول موج، به عنوان طیف جذب ترکیب شناخته میشود (شکل 5).
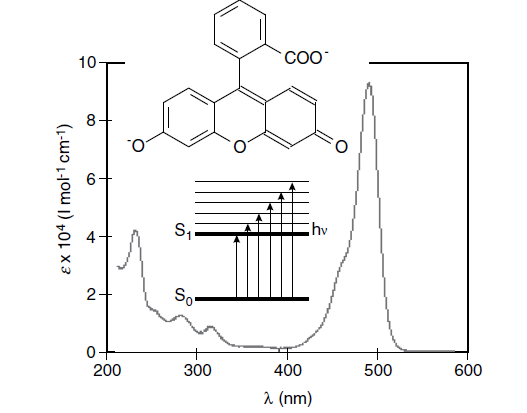
هنگامی که بیش از یک گونه با غلظت ci در نمونه وجود داشته باشد، جذب مجموع مشارکت های مختلف است:
A(λ)=[ε۱(λ) c۱+ε۲(λ) c۲+ ...]l
یک طیف جذبی A(λ) محدوده طول موجی را به ما نشان می دهد که یک مولکول می تواند در آن ناحیه نور را جذب کند و بنابراین اطلاعاتی در مورد انرژی های حالت الکترونی مولکول ارائه می دهد و بعلاوه، می توانیم اطلاعاتی در مورد ترکیب نمونه یا احتمال انتقال الکترونی به دست آوریم و بسته به ماهیت حالت پایه و مدار های حالت برانگیخته، این احتمال می تواند بسیار متفاوت باشد.
و در آخر به شما کاربر عزیز پیشنهاد میکنیم که محصولات شرکت دانش بنیان بلورآزما را مشاهده کنید و در صورت نیاز کاتالوگ هر محصول را به صورت جداگانه دانلود کرده و حتی برای دوستان خود بفرستید.
راستی این امکان هم برای شما قرار داده ایم که به صورت آنلاین از دستگاه مورد نظر خود استفاده کنید، برای استفاده کافیست وارد بخش محصولات سایت شده و محصول مورد نظر خود را انتخاب کرده و روی دکمه شبیه ساز آنلاین کلیک کنید
(خوشحالم که میتونی حتی به صورت آنلاین دستگاه های شرکت ما را ببینی و با آن کار کنی😍)
منابع و مراجع
Jan Helbing, TRANSCRIPT OF PHYSIKALISCH-CHEMISCHES PRAKTIKUM (Modul 211), Einführung, University of Zurich, 2017.
Valeur, M. N. Berberan-Santos, Molecular Fluorescence: Principles and Applications, Second Edition, Wiley‐VCH, 2012. ISBN:9783527650002. DOI:10.1002/9783527650002
Richard D. Beaty And Jack D. Kerber, Concepts, Instrumentation and Techniques in Atomic Absorption Spectrophotometry, 2nd Edition, 1993.



