آنچه در این مقاله میخوانید
طیف سنجی مولکولی، شاخه ای از علم است که به امواج الکترومغناطیسی و بررسی برهمکنش آنها بین مولکول ها می پردازد.
در حقیقت، طیف سنجی مولکولی به آنالیز طیفی حاصل از جذب، انتشار و پراکندگی تابش الکترومغناطیسی، در هنگام تابش به الکترون های درون ملکول ها می پردازد.
طبق قواعد مکانیک کوانتومی، الکترون های درون مولکول ها، سطوح انرژی مجزایی را اشغال می کنند و در هنگام دریافت انرژی یا از دست دادن آن، از یک حالت انرژی کوانتیزه به حالت دیگر تغییر می کنند.
دستگاه های طیف سنجی مولکولی نیز بر همین اصل عمل می کنند و با عبور دادن نور از ماده نمونه، مولکول های آنها را برانگیخته کرده و طیف نور عبوری از آنها را مورد آنالیز قرار می دهند.
با استفاده از طیف های مولکولی حاصل می توان برخی مشخصات بنیادین مواد را تشخیص داد که همین امر موجب می شود که طیف سنجی مولکولی کابردهای وسیعی در حوزه های مختلف صنعتی و آزمایشگاهی داشته باشد.
مکانیزم عملکردی طیف سنجی مولکولی مشابه با نوع طیف سنجی اتمی، اما مقداری پیچیده تر است و این پیچیدگی ها، به دلیل برهمکنش هسته های مختلف با یکدیگر و الکترون ها می باشد، پدیده ای که در اتم های تنها وجود ندارد.
به منظور آنالیز طیف های مولکولی لازم است به طور همزمان اثرات همه مشارکت های انواع مختلف حرکات و انرژی های مولکولی در نظر گرفته شوند.
به طور کلی، در هر مولکول، دو گروه از برهمکنش های داخلی اتفاق می افتد:
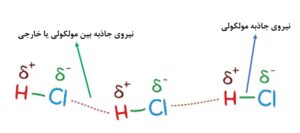
نمونه ای از برهمکنش های داخلی و خارجی یک ملکول
گروه دوم برهمکنش های مولکولی هستند که یک گروه از آنها، از برهمکنش گشتاور مغناطیسی یک هسته یا یک الکترون با یک میدان مغناطیسی خارجی ناشی می شوند.
ماهیت این نوع برهمکنش های مولکولی به شدت به محیط مولکولی که هسته یا الکترون در آن قرار دارد، بستگی دارد.
گروه دیگر از برهمکنش های مولکولی، به دلیل برهمکنش گشتاور چهارقطبی الکتریکی هسته ها با میدان الکتریکی تولید شده توسط الکترون های اطراف اتفاق می افتد که این دسته، اساس طیف سنجی رزونانسی است.
این نوع برهمکنش، همانطور که نام آن هم پیداست، شامل حرکات داخلی هسته های مولکول و نیرو های جاذبه و دافعه بین هسته ها و الکترون ها است.
علاوه بر این، برهمکنش داخلی شامل برهمکنش گشتاورهای مغناطیسی و الکترواستاتیکی هسته ها با همدیگر و با الکترون ها نیز می شود.
در حوزه فیزیک و مکانیک کلاسیک، برهمکنش های داخلی را می توان به سه دسته زیر تقسیم بندی کرد:
سه برهمکنش داخلی
علاوه بر سه مورد کلی بالا، الکترون های یک مولکول به دلیل حرکت دارای انرژی جنبشی نیز هستند و به دلیل دافعه متقابل آنها و جذب توسط هسته های مثبت، انرژی پتانسیل نیز دارند.
این دو عامل انرژی، به همراه انرژی پتانسیل ناشی از دافعه الکترواستاتیکی متقابل هسته های با بار مثبت، انرژی حاصل از برهمکنش های الکترونی یک مولکول را تشکیل می دهند.
در علم فیزیک و ریاضی، به جداسازی بخش انرژی الکترونی از سایر عبارات، تقریب بورن اوپنهایمر گفته می شود. برای ساده سازی برهمکنش های مولکولی از این تقریب استفاده می شود.
بر حسب این تقریب، هسته ها و الکترون های یک مولکول در معرض نیرو های یکسانی هستند، اما از آنجا که هسته ها بسیار سنگین ترند، معمولاً ثابت در نظر گرفته می شوند. (به منابع فیزیک کوانتوم مراجعه شود).
مولکول ها ساختارهای سفت و سختی نیستند و حرکت هسته ها درون یک چارچوب مولکولی باعث ایجاد سطوح انرژی ارتعاشی نیز می شود.
در یک مولکول دو اتمی، دو هسته درگیر یک حرکت ارتعاشی ثابت نسبت به یکدیگر هستند و معمولاً برای چنین سیستم هایی، حرکت ارتعاشی به صورت هارمونیک در نظر گرفته می شود.
شرایط لازم برای مشاهده یک طیف ارتعاشی برای یک مولکول دو اتمی، تغییر گشتاور دوقطبی آن در اثر ارتعاش است (در نتیجه مولکولهای دو اتمی همهسته از نظر ارتعاشی غیرفعال هستند).
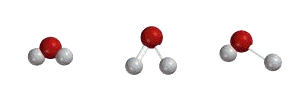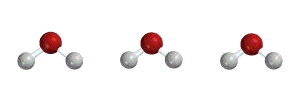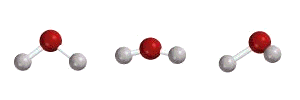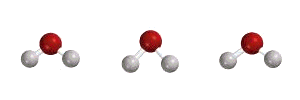
مدهای ارتعاشی مولکول آب
در فاز های جامد، مایع و گاز، تا جایی که مولکول ها از هم جدا باشند، می توانند چرخش آزاد نیز داشته باشند و در نتیجه دارای مقادیر کوانتیزه ای از انرژی دورانی نیز خواهند بود.
در حقیقت، طیف چرخشی مولکولی زمانی ایجاد می شود که یک مولکول از یک سطح چرخشی به سطح دیگر تغییر کند (طبق قوانین انتخاب مکانیک کوانتومی).
قوانین انتخاب، بر حسب تغییرات مجاز در اعداد کوانتومی که حالت های انرژی را مشخص می کنند، بیان می شود.
برای اینکه گذاری بین دو سطح انرژی چرخشی یک مولکول دو اتمی اتفاق بیفتد، باید گشتاور دوقطبی دائمی داشته باشد و این مستلزم آن است که دو اتم آن متفاوت باشند و قانون انتخاب رعایت شود.
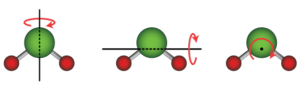
مدهای دورانی مولکول آب
به طور کلی، بسته با ساختار الکترونی و فضایی یک مولکول و همچنین برهمکنش های کلی آن، دارای چهار نوع سطح انرژی است:
انرژی مرتبط با توزیع الکترون ها در یک مولکول (اوربیتال های پیوندی و ضد پیوندی) که کوانتیزه است و اختلاف انرژی بین سطوح بیرونی در ناحیه طول موجی مرئی و فرابنفش است.
پیوند های موجود در یک مولکول همیشه ارتعاش دارند (به صورت کششی یا خم شدن). در هنگام ارتعاش، مرکز ثقل ثابت می ماند در حالی که موقعیت اتم ها تغییر می کند.
انرژی مرتبط با حرکت ارتعاشی نیز کوانتیزه است که اختلاف انرژی بین دو سطح انرژی ارتعاشی مجاور در ناحیه IR است.
مولکول ها در صورت داشتن فضا (به ویژه مولکول های گازی) حول محوری که از مرکز جرم می گذرد می چرخند و سطوح انرژی دورانی نیز کوانتیزه شده است.
اختلاف انرژی بین سطوح انرژی دورانی، در حد و مرتبه امواج ناحیه مایکروویو طیف الکترومغناطیسی است.
علاوه بر موارد بالا، حرکت انتقالی نیز وجود دارد که موقعیت مرکز جرم تغییر می کند و در این حرکت، تفاوت بین سطوح انرژی آنقدر کوچک است که قابل مشاهده نیست (تقریباً صفر) و حرکت به صورت پیوسته به نظر می رسد.
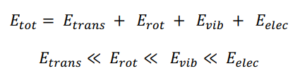
سطوح انرژی انتقالی
بنابراین گذارهای طیفی ممکن در یک مولکول، گذارهای چرخشی، ارتعاشی و الکترونی هستند.
Etotal = Eelectronic + Evibratinal + Erotational
برهمکنش تابش الکترومغناطیسی بین سطوح انرژی مولکولی، اساس طیف سنجی الکترونی، طیف سنجی مولکولی UV-Vis-IR، طیف سنجی رامان و غیره را تشکیل می دهد.
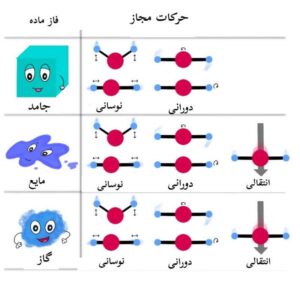
گذارهای ممکن در فازهای جامد، مایع و گاز
فواصل انرژی دورانی بسیار کوچکتر از فواصل انرژی ارتعاشی است، زیرا ارتعاش شامل اعوجاج مولکول است که به انرژی بیشتری نسبت به چرخش نیاز دارد.
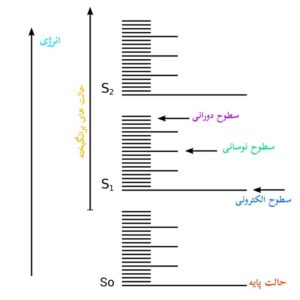
فاصله نسبی سطوح انرژی گذارهای الکترونی، ارتعاشی و چرخشی
طیف اتم ها از خطوط تیزی تشکیل شده است که دلیل آن گذارهای الکترونی در بین اوربیتال های مختلف مجاز انرژی است.
اما طیف های مولکولی (در طیف سنجی مولکولی) از نوارهایی تشکیل شده اند که در آنها یک ساختار خطی چگال با وضوح بالا دیده می شود.
این موضوع، به این دلیل است که علاوه بر گذار الکترون ها، مولکول ها می توانند انرژی خود را به دو روش دیگر نیز تغییر دهند (تغییر در انرژی های چرخشی و ارتعاشی).
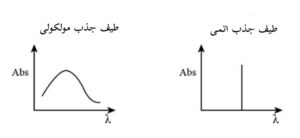
تفاوت طیف های جذب اتمی و مولکولی
توزیع الکترون ها در بین اوربیتال های مولکولی مختلف، نظریه اوربیتال مولکولی نامیده می شود که اساس طیف سنجی مولکولی می باشد و ویژگی های برجسته این نظریه عبارت اند از:
ترکیب خطی اوربیتال های اتمی، برای تشکیل اوربیتال های مولکولی تنها در صورتی انجام می شود که شرایط زیر برآورده شوند:
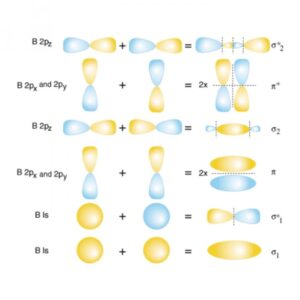
نحوه تشکیل اوربیتال های مولکولی
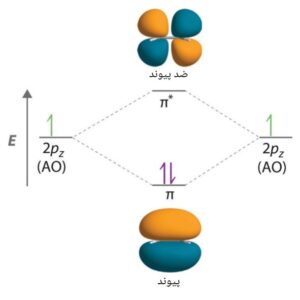
تشکیل اوربیتال های مولکولی π و *π
بحث دقیق در مورد احتمالات گذار فراتر از محدوده این سایت است، اما یک عامل تأثیرگذار، میزان همپوشانی اوربیتال های درگیر در تحریک الکترونی است:
برای مولکول هایی که دارای پیوند هایی مانند آلکن ها، آلکین ها، آروماتیک، ترکیبات اکریل یا نیتریل هستند، تابش نور و جذب آن می تواند الکترون ها را از یک اوربیتال مولکولی پیوندی π به یک اوربیتال مولکولی ضد پیوندی *π ارتقا دهند که به گذار قوی π→*π معروف هستند (با ضریب جذب مولی بالا (Ԑ)).
گروه هایی از اتمها که در پیوند نقش دارند، اغلب کروموفور نامیده میشوند. انرژی گذار (یا طول موج جذب) می تواند نشانه ای برای انواع مختلف پیوندها (کربن-کربن، اکسیژن -کربن یا کربن-نیتروژن در گروه نیتریل) باشد.
الکترون های جفت تکی، که در اتم های اکسیژن و نیتروژن وجود دارند، ممکن است از اوربیتال مولکولی غیرپیوندی خود به یک اوربیتال مولکولی ضد پیوند *π ارتقاء پیدا کنند.
این انواع در مقایسه با گذار های نوع π→π* مشابه در کروموفورها، به انرژی کمتری (طول موج بلندتر) نیاز دارند. با این وجود، احتمال گذار معمولاً بسیار کمتر است.
ترکیبات اشباع شده با جایگزین های حاوی جفت های تنها، مانند آب، آمونیاک، هیدروژن دی سولفید فقط گذار های n→σ* و σ→σ* و در محدوده طیفی مرئی-فرابنفش دارند.
بسیاری از محلول های حاوی یون فلزات واسطه، تا حدی با سطوح d پر میشوند، که امکان ارتقای یک الکترون را به حالت برانگیخته (با تغییر جایگاه اوربیتالی در سطح d) با جذب نور مرئی نسبتاً کم انرژی فراهم میکنند.
نوار های طیفی آنها اغلب پهن هستند و به شدت تحت تأثیر محیط شیمیایی قرار می گیرند.
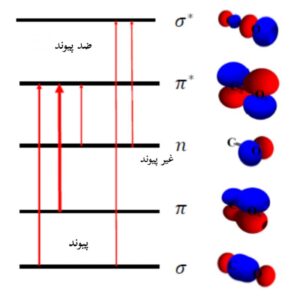
انواع گذارهای الکترونی در مولکول ها
اکثر انواع طیف سنجی مولکولی به عنوان طیف سنجی جذبی شناخته می شوند و مکانیزم اصلی آنها از طریق جذب نور جذب است، زیرا مولکول ها انرژی نور را در طول موج های خاص (فرکانس های رزونانس آنها) جذب می کنند.
طیف سنجی جذبی را می توان به انواع مختلفی دسته بندی کرد که هر کدام کاربردهای ویژه و ساختارهای متفاوتی دارند:
با این حال، انرژی جذب شده ممکن است به دلیل پراکندگی یا انتشار نور تابشی نیز ایجاد کند. اندازهگیری چنین تابشی به عنوان طیف سنجی نشری نامیده می شود که شامل تکنیکهایی مانند رامان و فلورسانس/فسفرسانس است.
در طیف سنجی مولکولی، با اندازه گیری شدت نور زمانی که یک پرتو نور از محلول نمونه عبور می کند، می توان غلظت آن را بدست آورد.
اصل اساسی این است که هر ترکیب یا ماده، نور را در محدوده خاصی از طول موج جذب یا منتقل می کند و مقدار نور جذب شده توسط نمونه با غلظت گونه های جذب کننده در نمونه نسبت مستقیم دارد.
معمولاً سه نوع اساسی از سیستم های طیف سنجی مولکولی وجود دارد:
یک طیف سنج ملکولی معمولاً از یک منبع نور، یک نگهدارنده نمونه، یک تک رنگ ساز، یک آشکارساز و یک دستگاه بازخوانی تشکیل می شود.
منبع نور طیف وسیعی از نور را ساطع می کند که از تک رنگ ساز عبور می کند و نور را به طول موج های اجزای آن جدا می کند.
سپس نور تک رنگ از طریق نمونه هدایت می شود که مقداری از آن جذب ماده می شود و یا بازتابیده می شود.
آشکارساز مقدار نوری را که از نمونه عبور کرده است را اندازه گیری می کند و دستگاه بازخوانی نتایج را نمایش می دهد.
در طیف سنجی مولکولی نوع نشری، ابتدا با استفاده از یک منبع انرژی مانند تخلیه الکتریکی یا پلاسما، الکترون ها به سطوح بالاتر برانگیخته می شوند.
تابش ساطع شده از مولکول های برانگیخته که به حالت های انرژی اولیه باز می گردند و با استفاده از یک عنصر تک رنگ ساز یا چند رنگ ساز (منشور، توری پراش و …) به سیستم آشکارساز رسیده و آنالیز می گردد.
نواحی اصلی عملکردی این طیف سنج ها، معمولاً نواحی مرئی و فرابنفش است و کاربردهای گسترده ای در علوم مختلف دارند.
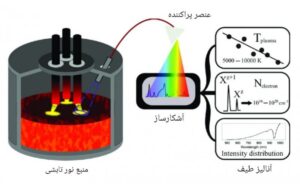
شماتیک نوعی از طیف سنجی مولکولی نشری
طیفسنج مولکولی نوع جذبی، که بیشترین کاربرد را در بین انواع دیگر دارند، بیشتر در محدوده طول موجی مرئی و فرابنفش عمل می کنند.
در این دستگاه ها، ابتدا برای ارائه باریکه ای با طول موج یا پهنای باند خاص، نور منبع را از یک عنصر تک رنگ ساز یا چند رنگ ساز عبور می دهند (البته این مرحله قبل از رسیدن نور به آشکارساز باشد).
سپس، باریکه نور حاصل از ماده مورد آنالیز مجهول عبور کرده و بخشی از آن، جذب ماده می شود. نور عبوری باقیمانده به آشکارساز می رسد و شدت آن ثبت می شود.
در نهایت، علاوه بر اینکه طیف نمودار شدت جذب بر حسب فرکانس را ارئه خواهد داد، می توان غلظت گونه های جاذب را نیز بدست آورد.
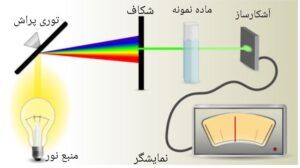
شکل8- شماتیک نوعی از طیف سنجی مولکولی جذبی
این نوع از دستگاه های طیف سنجی، از انواع جذبی معمولی هستند اما سرعت، وضوح و حساسیت بیشتری دارند. در این طیف سنج ها، نمونه تحت یک منبع پرتو باند پهن قرار می گیرد.
نتیجتاً، به دلیل جذب بخش خاصی از تشعشع، یک تداخل گرام ایجاد می شود. معمولاٌ، این تداخل گرام (تابعی از شدت سیگنال بر حسب زمان) دیجیتالی شده و با استفاده از تبدیل فوریه به طیف جذبی تبدیل می شود.
طیف سنج های تبدیل فوریه را می توان طوری طراحی کرد که تمام نواحی طیفی، از فرکانس رادیویی تا پرتو ایکس را پوشش دهند.
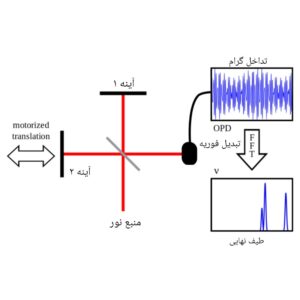
شکل9- شماتیک نوعی از طیف سنجی مولکولی تبدیل فوریه
اساس طیف سنجی مولکولی تحریک مولکول ها توسط فوتون ها است. مولکول های برانگیخته شده از حالت پایه، بسته به ماهیت تغییرات انرژی، تحت ارتعاشات تشدید یا گذار الکترونی قرار می گیرند.
گذار ارتعاشی مربوط به تغییرات در حالات ارتعاشی مولکول است و معمولاً در ناحیه مادون قرمز ظاهر می شود.
گذارهای الکترونی مربوط به تغییرات در حالت الکترونی مولکول ها هستند و معمولاً در نواحی طیفی UV-Vis ظاهر می شوند.
در آخر به شما کاربر عزیز پیشنهاد می کنیم که از بخش محصولات شرکت دانش بنیان بلورآزما را هم دیدن کنید و در صورت نیاز کاتالوگ هر محصول را به صورت جداگانه دانلود کرده و حتی برای دوستان خود بفرستید.
Jan Helbing, TRANSCRIPT OF PHYSIKALISCH-CHEMISCHES PRAKTIKUM (Modul 211), Einführung, University of Zurich, 2017.
svanberg, Atomic and molecular spectroscopy, 4th Edition, Springer. ISBN:3-540-20382-6
kakkar, Atomic and Molecular Spectroscopy: Basic Concepts and Applications, Cambridge University Press, 2015. ISBN 978-1-107-06388-4
B. Gray, Chemical Bonds: An introduction to atomic and molecular structure, University Science Books, 1994. ISBN: 0-935702-35-0
بلوری زاده، محمدآقا، فیزیک اتمی و مولکولی، روشهای تجربی، نشر فلامک، 1382.
مقالات منتشر شده در ساعاتی قبل